2020年3月28日,美国吉利德科学公司的CEODaniel O'Day发布一封公开信,再度将瑞德西韦(Remdesivir)拉进人们的视线。
根据这封公开信,当新冠病毒出现时,吉利德便开展了瑞德西韦治疗潜力的研究,该公司正在加快临床试验,已向1000多名患者提供瑞德西韦。
瑞德西韦是一款未上市的抗病毒药物,由吉利德科学研发。此前,美国食品和药品监督管理局(FDA)曾批准瑞德西韦“孤儿药”资格,其适应证为新冠病毒肺炎(COVID-19)。不过,多家非政府组织公开质疑,吉利德科学此举是在钻法律空子,仅两天后,吉利德便向FDA申请撤销孤儿药认证。
瑞德西韦是目前最有希望治疗COVID-19的抗病毒药物。围绕瑞德西韦正在进行6项临床试验,治疗不同类型的COVID-19患者。其中,在中国进行的两项临床试验结果将在4月下旬揭晓。
即便该药的安全性和有效性得到证实,未来在中国市场仍然将面临专利纠纷。
中国科学院武汉病毒研究所,于2020年1月21日,提交了“瑞德西韦在制备用于治疗2019新型冠状病毒药物中的应用”的专利申请。
而2016年9月16日,吉利德公司曾在中国提交瑞德西韦用途专利申请,其可能获得授权的主题是“瑞德西韦在制备治疗SARS或MERS病毒药物中的应用”。SARS和MERS皆是冠状病毒家族成员。
北京一名知识产权律师告诉《财经》记者,武汉病毒所的专利申请,不可能落入吉利德科学2016年冠状病毒用途申请的保护范围,但一定会落入2011年的瑞德西韦化合物专利的保护范围,这项专利还没到期。
药品还未获批,围绕其中的专利纠纷依然疑云遍布。事实上,跨国药企在中国的专利纠纷,早已是常态。
仿制药企发起专利挑战,国家知识产权局做出专利无效或者有效维持的决定,原研药企或者挑战者不服决定、发起诉讼,这几乎是制药行业专利战争的固定剧情,在全球都会发生。在中国,这种纠纷发生频次更高。
据《财经》记者不完全统计,近十年,至少53项药品相关专利被国家知识产权局复审部门宣布无效,多数进入法律诉讼环节。
围绕原研药专利的纠纷,主要分为三种:专利授予纠纷,发生于专利申请者与专利部门之间;专利挑战的纠纷,发生于原研药企与仿制药企或个人挑战者之间;专利侵权纠纷,发生于原研药企与仿制药企之间。其中,由专利挑战引发的纠纷与诉讼,近些年发生最为频繁。
专利链接制度,被视为仿制药上市前调和仿制药企与原研药企专利矛盾的“良方”,中国药、法两界为此激烈讨论。这一制度在正式的文件中仍然是“探索建立”,不过,一些创新型国内药企此次和跨国药企站到了一边,积极呼吁推出专利链接制度。
强仿获批合理否
“真不知该怎么向公司总部交代,总公司老板看到的是中国越来越重视保护知识产权,可我们不得不通知他们哪款专利药被强仿了、专利被挑战后无效了,甚至有时还输了官司。”一位跨国药企在华公司知识产权部门负责人接受《财经》记者采访时说。
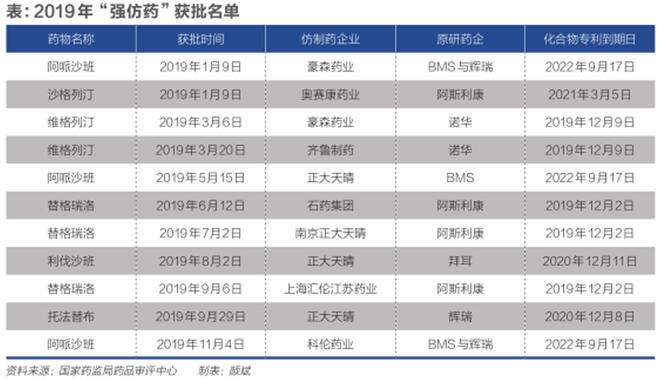
《财经》记者查询国家药监局药品审评中心(CDE)相关审评信息统计发现:从2019年1月到11月,CDE共批准了11款“强仿药”上市;获批之时,这些药物的化合物专利均未到期,距离专利到期少则三个月,多则三年半(见表)。
现行的《专利法》规定:“在国家出现紧急状态或者非常情况时,或者为了公共利益的目的,国务院专利行政部门可以给予实施发明专利或者实用新型专利的强制许可。”
“业内一般认为一些传染病药物,当发生重大疫情时才有可能启动强仿。这11款显然不属此列。”上述跨国药企知识产权负责人说。2019年,该公司一款专利药,在华专利还没到期便有国内仿制药拿到了上市批件。
这11款药物涉及到的原研药,专利均握在跨国大药企手中。专利保护期的每一天,对原研药企都很重要,这意味着独家销售。仿制药一旦获批上市销售,原研药的价格与收益一般都大幅下降。
沙格列汀首仿药于2019年1月9日获批,然而,相应的原研药的化合物专利到期日为2021年3月5日。根据全国百床以上医院数据库统计,这款原研药2018年在中国的销售额为3.4亿元。
仿制药获批三个多月后,该原研药企业阿斯利康向仿制药企业奥赛康发起专利侵权诉讼,认为奥赛康的沙格列汀片落入其ZL01806315.2号中国发明专利的保护范围,并提出立即停止侵犯原告涉案专利权的行为、在涉案专利有效期内不得制造、使用、销售、许诺销售侵权产品、50万元经济损失等诉讼请求。
目前,奥赛康药业母公司发布的公告显示,江苏省南京市中级人民法院已受理该案。
另一款引发纠纷的是拜耳的利伐沙班。2019年8月2日,利伐沙班的首款仿制药获批,拜耳的利伐沙班相关专利则在7月被国家知识产权局宣告无效。2019年10月,拜耳对江苏中邦发起专利侵权诉讼。
全国百床以上医院数据库的数据显示:2018年,重点省市公立医院利伐沙班销售额为5.7亿元。国内已有22家仿制药企业完成该药的BE试验。齐鲁制药、柯菲平盛辉制药的利伐沙班仿制药已在2019年底递交上市申请。
现行的《药品注册管理办法》规定:对他人已获得中国专利权的药品,申请人可以在该药品专利期届满前2年内提出注册申请;国家药监局在专利期满后核发药品批准文号。
未到专利期满,就批准仿制药上市,药监局有自己的说法。
“药监局是行政部门,依法行政,我们在审药时只是考虑药品的安全性与有效性,让评审员去研究专利,这不现实。”国家药监局一名不愿具名的官员对《财经》记者分析。
欧盟也认为,药品监管机构的任务是核查药品安全性和有效性,不应考虑产品是否侵犯专利权等其他因素。同样,印度通过法院判例明确,药品上市审批机构只需审核药品的安全性和有效性,无须考虑专利纠纷的因素。
况且,“还有Bolar例外规定”。上述国家药监局官员说。2008年,《专利法》第三次修正时,引入美国的Bolar例外制度,即为行政审批所需提供的相关信息而制造、使用、进口专利药的,不视为侵犯专利权。
这一条文避免了原研药的专利保护期因研发、申请上市而无形中延长。此前,仿制药企只能在原研药专利到期后,才能进行仿制研发、申请上市,而研发与上市都需要一定的时间。
在美国,原研药的专利到期前,药企大可以研发仿制药,但是不能提交上市申请,也无法得到美国食品和药品监督管理局(FDA)的批准。“一旦提交上市申请就被视为侵权,因为有拟制侵权的限制。”一名熟悉美国药品审评制度的知识产权专家告诉《财经》记者,中国没有此限制,就容易把Bolar例外扩大化,“甚至扩大到上市审批”。
一旦Bolar例外允许的行为被扩大,对侵权行为的认定缩小了,就会出现原研药专利到期前仿制药申请上市、审批的强仿事件。
“不少强仿涉及到的专利药企给药监局写信反映。”北京市高级人民法院知识产权庭原副庭长程永顺说,“以前药监局批过一个之后要等几年,像2019年这样一月批准一强仿,势必埋下专利纠纷、专利诉讼的隐患。”
2019年12月13日,最高法对一项生物基因技术药物专利行政案件做出终审判决:维持一审判决,要求国家知识产权局重新作出审查决定。最高法在案情说明中指出,国家知识产权局“审查实践中出现创造性的法律标准被异化的现象”,并认为此次判决“对于纠正这一审查偏向,使各项审查标准重回正轨具有指导意义”。
程永顺对《财经》记者说,此案“给创新药企、专利权人,在专利纠纷、诉讼中带来一些希望”。
让诉讼终结矛盾?
程永顺此前的担心不无道理,针对2019年获批的强仿药,有原研药企或在布局,或已经发起了诉讼。
获批的仿制药,在专利到期前,只有成功挑战原研药的专利,才能顺利上市。不然,要么迎来专利诉讼,要么与原研药企达成和解。
《财经》记者梳理2013年至今的20项药品专利纠纷案发现:几乎所有的知名跨国药企均有案在身,12个已经完成终审或一审后未上诉的案子中,原研药企胜、负各半。
2018年,诺华制药的重磅心衰药物沙库巴曲缬沙坦钠片的一项专利无效案,曾让国内仿制药企兴奋不已。
该药在中国主要有三项保护专利,其中一项为药物组合物,本于2023年1月16日到期,因广东胜伦律师事务所合伙人戴锦良,向国家知识产权局原专利复审委,提出该药物的组合物专利无效申请,2018年1月,原复审委宣布该项专利权全部无效。
之后,诺华将国家知识产权局与戴锦良告上法庭。2019年6月,北京知识产权法院宣判维持原专利复审委的决定。戴锦良告诉《财经》记者,“诺华已经提起上诉,将由最高法知识产权法庭进行二审。”
这项对簿公堂的专利,目前虽然仍是“专利维持状态”,但国内10余家仿制药企已经布局仿制研发。2018年11月,上海宣泰海门药业提交了沙库巴曲缬沙坦钠片的仿制药上市申请,成为国内第一家仿制上市申请。
据立方律师事务所合伙人李春暄不完全统计,国内药品专利相关诉讼,获得二审判决书的平均时长是357天,最长的1257天。照此算来,沙库巴曲缬沙坦钠片的药物组合物专利到期之前,有望得到终审宣判。
即便如此,仿制药企也难放下心来——该药另两项专利将于2026年11月8日到期。要想无忧无虑地仿制,仿制药企需要再走两遍程序:发动专利无效申请。或者,走另外一条路:强仿获批,上市卖药,与诺华走专利纠纷诉讼。
戴锦良分析,2019年强仿药中,已经埋下专利纠纷的祸根。
阿斯利康拥有的替格瑞洛,化合物专利于2019年12月2日到期,在此前,已经有三款仿制药获批。2018年,深圳信立泰药业与阿斯利康进行过一轮法庭对撞,最终北京高院二审判决撤销复审委无效决定,阿斯利康胜出。
“法官相信的是数据、证据,不会只听原告、被告怎么说。”程永顺说,不过,受专业限制,不同的法庭、法官对于药品专利权的诉讼案判决尺度很难统一。
2019年获批的11个批号共涉及6款原研药,其中有2款药的化合物专利已于2019年12月到期,其余4款药的化合物专利将陆续于未来三年内到期,药品晶型、中间体等其他专利期限尚不可知。
这意味着,这4款药的拥有者辉瑞、阿斯利康、拜耳、百时美施贵宝,将面临汹汹而来的专利无效申请,及行政诉讼或专利侵权诉讼。
如今,知识产权案件的二审,由最高人民法院审理,这对避免地方保护等是积极信号。“目前来看,强仿看似谁都没有责任,但毕竟专利权被侵犯了,总要一方来承担责任。”上述知识产权专家说。
专利链接制度“难产”
一方是高高筑起的专利围墙,一方是跃跃欲试的仿制药企,被裹挟其中的还有国家知识产权局、国家药监局。
仿制药上市审批过程中存在的潜在专利侵权纠纷,是一个全球制药界都存在的难题。欧盟的做法是:专利权人可以向法院申请“临时禁令”,阻止仿制药的上市审批程序。
日本则是,新药活性成分产品专利期尚未届满的情况下,不批准仿制药上市;甚至规定在新药活性成分专利届满前,禁止提交仿制药申请。
美国、加拿大、澳大利亚和韩国采用的是专利链接制度,即仿制药的上市申请审批与相应的药品专利有效性审核的程序链接,将药监部门与专利授予部门的职能链接。
在中国,这项制度在药界与法界被讨论十余年。“建立专利链接制度,会遏制强仿的数量与进度,也会刺激强仿者去挑战专利。”戴锦良认为,专利链接制度下,如果专利挑战成功,挑战者一般会享受到一些政策红利,如加快审评、绿色通道等。
2008年《专利法》第三次修订时,专利链接制度成为征求意见阶段的焦点议题。“当时起草修正案的专利部门认为这是一项美国的制度,不符合当时的国情。”一名参与该法修改的知识产权专家告诉《财经》记者,“一是为了满足老百姓的用药需求,二是为了保护本土仿制药企。”
国务院办公厅曾印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(42号文),提及“探索建立药品专利链接制度”。至今,该文件规划的改革措施多数正在执行或已完成,只有专利链接制度似乎还停留在原地。
2019年11月9日,中国医药创新促进会执行会长宋瑞霖公开表示:“新版《药品管理法》让我最遗憾的是,没有把专利链接制度写入。”
如宋瑞霖所言,《药品管理法》征求意见稿中的表述是,“专利链接制度涉及药品专利权人和仿制药企业的利益,以及对药品可及性和公共健康产生影响。有关原则需在更高位阶法规中体现。”
“更高位阶法规”指的是《专利法》。
2018年下半年,《专利法》第四次修订启动。“比较慢,曾经在2018年、2019年列入全国人大立法工作计划,一般都是当年必须要过的,现在拖到了2020年。”程永顺说。不过,《专利法修正案(草案)》中,未提及专利链接制度。
“专利链接制度上了总理办公会,本没有大的阻力了。从技术上,完全没有难度。”上述知识产权专家向《财经》记者透露,“如果没有2018年长生疫苗事件导致药监部门大换血,与之后的中美贸易战,可能很快就先落地了。”
尽管如此,没有任何制度是完美的。李春暄认为,在现行的体制下,实施专利链接制度后,药监部门与专利部门的衔接是个难点。此外,关于药品专利相关侵权诉讼,一审平均需要445天,二审则需要357天,“这么长时间,药监局怎么批?等诉讼结束后再批,又会被诟病行政效率差”。
前进的信号是,中国制药行业虽然还是以仿制药企业为主,但已经有几十、上百家创新主导的企业。过去提出专利链接制度建议的都是跨国药企,这次《专利法》修订,不少本土创新企业也积极呼吁推出专利链接制度。
【版权声明】本作品著作权归《财经》独家所有,授权深圳市腾讯计算机系统有限公司独家享有信息网络传播权,任何第三方未经授权,不得转载。


